Kimyasal Tepkimeler Çalışma Kağıdı
Çok faydalı bir çalışma kağıdı! Kimyasal tepkimeler çalışma kağıdındaki çoktan seçmeli sorular ile kimyasal tepkimeler konusu pekiştirilebilir. Çalışma kağıdına aşağıdaki linkten erişebilirsiniz.
>> Kimyasal Tepkimeler Çalışma Kağıdı (16100 indirme)
İndirme önizlemesi:
Hedeflenen Kazanımlar:
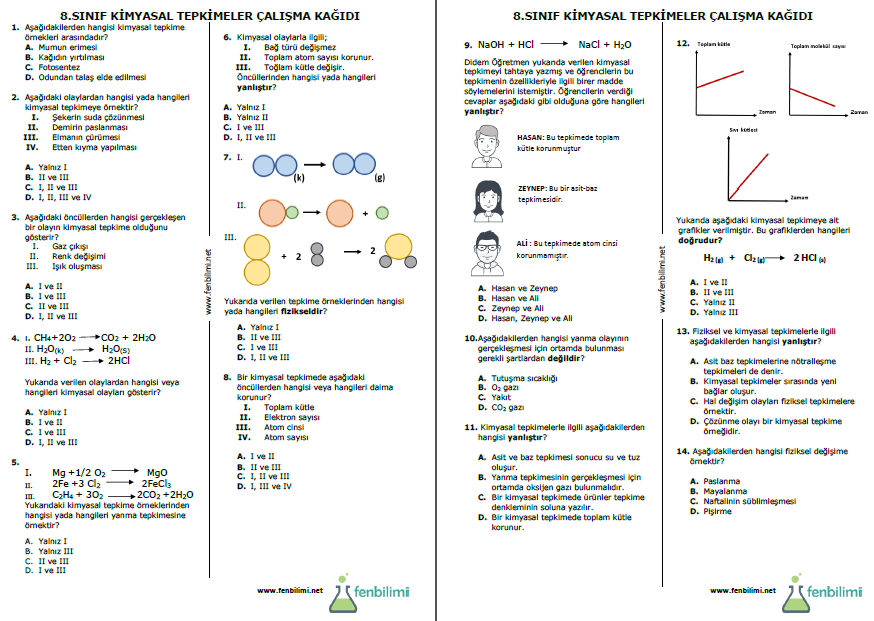
8.3.5. Kimyasal Tepkimeler
8.3.5.1. Kimyasal tepkimeleri, bağ oluşumu ve bağ kırılımı temelinde açıklar.
8.3.5.2. Kimyasal tepkime türlerini kavrar.
8.3.5.3. Kimyasal tepkimelerde kütlenin korunduğu sonucunu çıkarır.
a. Kimyasal tepkime türlerinden sadece yanma ve asit-baz tepkimelerine değinilir.
b. Kimyasal tepkimelerin denkleştirilmesine girilmez.
2. B 6.C 10.D 14.C
3. D 7.A 11.C
4. C 8.D 12.D
Çalışma kağıdının konu anlatımına buradan erişebilirsiniz.
 Bizlere destek olmak için sayfanın en altına yorum yapabilir veya sosyal medyadan çalışmalarımızı paylaşabilirsiniz. Geri bildirimleriniz bizim için önemli. Tekrar görüşmek üzere.
Bizlere destek olmak için sayfanın en altına yorum yapabilir veya sosyal medyadan çalışmalarımızı paylaşabilirsiniz. Geri bildirimleriniz bizim için önemli. Tekrar görüşmek üzere.



Didem hocam hazırladığınız güzel çalışmalarınızı bizimle paylaştığınız için teşekkür ederim,okuldaki öğrencilerimle istifade ediyoruz,emeğinize sağlık 🙂
Şebnem hocam selamlar, çalışmalarımı güzel bulmanıza inanın çok sevindim. Çalışmalarımı kullanan ve bunlardan faydalanan insanların olması beni daha da motive ediyor ve işimi daha severek yapıyorum. Esen kalmanız dileğiyle..
Paylaşımlarınızı çok beğeniyorum , çalışma kağıtlarınızı her hafta düzenli takip etmeye başladım.
Emeğinize sağlık
Merhabalar, beğenmenize çok sevindim. Öğretmen ve öğrencilerimiz için faydalı içerikler oluşturmaya çalışıyorum. Sağlıcakla kalın..