Güncel Fen Bilimleri, Bilim Uygulamaları, Zeka Oyunları öğretim programı, ünitelendirilmiş yıllık planlara, bireyselleştirilmiş eğitim planlarına aşağıdaki linklerden ulaşabilirsiniz. Fen Bilimleri Dersi Ünitelendirilmiş Yıllık Planlar: >> >> >> >> Fen …
8.Sınıf Mevsimler ve İklim ünitesi Mevsimler ve İklim Çalışma Kağıdı-2 ‘ye aşağıdaki linkten erişebilirsiniz. Hedeflenen kazanımlar yazının devamında bulunmaktadır. >> İndirme Ön İzlemesi: Hedeflenen Kazanımlar: Mevsimler ve İklim Çalışma …
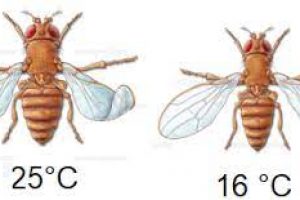
Bu konumuz içinde adaptasyon, adaptasyonun neden olduğu adaptasyon doğal seçilim ve varyasyon konularını öğreneceğiz. Adaptasyon Canlının değişen ortam koşullarına uyum sağlayarak, yaşama ve üreme şansını arttırmasını sağlayan özellikler kazanmasına …
Bu konu içinde mutasyon modifikasyon kavramlarını ve özelliklerini, bu kavramların canlılar üzerindeki etkilerini öğreneceğiz. Mutasyon DNA’nın kendini eşlemesi sırasında, DNA üzerinde meydana gelen şifre değişikliklerine mutasyon denir. Mutasyona neden …
Anne ve babadan, yeni kuşaklara aktarılan özelliklere kalıtsal özellikler, bu özellikleri inceleyen bilim dalına kalıtım (genetik) denir. Kalıtım biliminin kurucusu Gregor Mendel‘dir. Mendel kalıtım ile ilgili çalışmalarını bezelye bitkisi …
Bu yazımızda Güneş ve Ay tutulmaları nı inceleyeceğiz. 5.sınıfta öğrendiğimiz ışığın yayılması ve tam gölge ile Güneş, Dünya ve Ay’ın özellikleri konusunu hatırlamak isteyenler linklerden bu yazılara ulaşabilirler. Güneş …
Bu konuda Güneş Dünya ve Ay’ın hareketi ni, birbirlerine göre hangi dönme ve dolanma hareketlerini yaptıklarını, hangi yöne ne kadar sürede döndüklerini öğreneceğiz. Güneş ve Hareketleri Güneş’in yaptığı iki …
Bu konumuz içinde Ay’ın Evreleri ve Hareketleri konusunu inceleyeceğiz. Bu konuya başlamadan önce Güneş ve Ay’ın Yapısı ve Özellikleri konusuna göz atabilirsiniz. Ay, Dünya’ya en yakın gök cismidir ve …
Güneş, Güneş’in yörüngesinde dolanan gezegenler, meteorlar ve asteroitler, tozlardan oluşan sisteme Güneş Sistemi denir. Güneş Sistemi’nde 8 tane gezegen bulunmaktadır. Bunlar Güneş’e uzaklık sırasına göre en yakından en uzağa …
Renklerin oluşumu konusu içinde; beyaz ışığın renklere ayrılması, cisimlerin renkli görünmesi, Newton çarkı konularını öğreneceğiz.. Beyaz Işığın Renklere Ayrılması (Işık Tayfı) Beyaz ışık, yani Güneş Işığı, renklerin birleşmesi ile …
8.Sınıf Mevsimler ve İklim ünitesi Mevsimler ve İklim Çalışma Kağıdı-2 ‘ye aşağıdaki linkten erişebilirsiniz. Hedeflenen kazanımlar yazının devamında bulunmaktadır. >> İndirme Ön İzlemesi: Hedeflenen Kazanımlar: Mevsimler ve İklim Çalışma …
Bu konumuz içinde adaptasyon, adaptasyonun neden olduğu adaptasyon doğal seçilim ve varyasyon konularını öğreneceğiz. Adaptasyon Canlının değişen ortam koşullarına uyum sağlayarak, yaşama ve üreme şansını arttırmasını sağlayan özellikler kazanmasına …
Bu konu içinde mutasyon modifikasyon kavramlarını ve özelliklerini, bu kavramların canlılar üzerindeki etkilerini öğreneceğiz. Mutasyon DNA’nın kendini eşlemesi sırasında, DNA üzerinde meydana gelen şifre değişikliklerine mutasyon denir. Mutasyona neden …
Renklerin oluşumu konusu içinde; beyaz ışığın renklere ayrılması, cisimlerin renkli görünmesi, Newton çarkı konularını öğreneceğiz.. Beyaz Işığın Renklere Ayrılması (Işık Tayfı) Beyaz ışık, yani Güneş Işığı, renklerin birleşmesi ile …
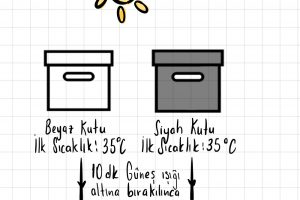
Işığın soğurulması ve renkler konusu içinde, ışığın soğurulması nedir, ışığın soğurulması sonuçları nelerdir, beyaz ışığın renklere ayrılması ve cisimlerin renkli görülmesi konularını işleyeceğiz. Işığın Soğurulması Soğurulma: Maddelerin ışık ışınlarını …
İki yada daha fazla maddenin, kendi özelliklerini kaybetmeden birleşmesine karışım denir. Karışımlar, heterojen ve homojen karışımlar olmak üzere iki çeşittir. HATIRLA! MADDE: A. SAF MADDE: Element-Bileşik B.SAF OLMAYAN MADDE …
Bu yazımızda Güneş ve Ay tutulmaları nı inceleyeceğiz. 5.sınıfta öğrendiğimiz ışığın yayılması ve tam gölge ile Güneş, Dünya ve Ay’ın özellikleri konusunu hatırlamak isteyenler linklerden bu yazılara ulaşabilirler. Güneş …
Güneş, Güneş’in yörüngesinde dolanan gezegenler, meteorlar ve asteroitler, tozlardan oluşan sisteme Güneş Sistemi denir. Güneş Sistemi’nde 8 tane gezegen bulunmaktadır. Bunlar Güneş’e uzaklık sırasına göre en yakından en uzağa …
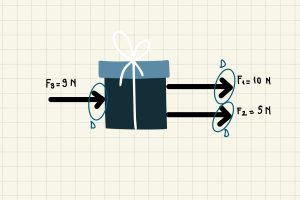
Net kuvvet (Bileşke Kuvvet) konusunda; kuvvetin özellikleri, bileşke kuvvet nasıl bulunur ve dengelenmiş-dengelenmemiş kuvvetler konularına değineceğiz. Kuvvet Duran bir cismi harekete geçiren, Hareket eden bir cismi durduran, hızlandıran, yavaşlatan, …
Bu konuda Güneş Dünya ve Ay’ın hareketi ni, birbirlerine göre hangi dönme ve dolanma hareketlerini yaptıklarını, hangi yöne ne kadar sürede döndüklerini öğreneceğiz. Güneş ve Hareketleri Güneş’in yaptığı iki …
Bu konumuz içinde Ay’ın Evreleri ve Hareketleri konusunu inceleyeceğiz. Bu konuya başlamadan önce Güneş ve Ay’ın Yapısı ve Özellikleri konusuna göz atabilirsiniz. Ay, Dünya’ya en yakın gök cismidir ve …
5. Sınıf Kuvvetin Ölçülmesi ve Sürtünme Kuvveti Ünitesi’ne Kuvvetin ÖlçülmesiSürtünme Kuvveti konuları olmak üzere iki konuda ele alacağız. Kuvvet çeşitleri 2’ye ayrılır: A.Temas Gerektiren Kuvvetler: Cisimler arasında fiziksel temas …